УДК 615.214.22:638.8
ГАБИТАБС – НОВЫЙ ПОДХОД К ЛЕЧЕНИЮ ИДИОПАТИЧЕСКОГО ЦИСТИТА КОШЕК
Костянко Николай Олегович*, Шантыз Азамат Хазретович*✉, Жолобова Инна Сергеевна*, Лысенко Юрий Андреевич*, Марченко Евгений Юрьевич*, Петрова Ольга Владиславовна**
*Кубанский государственный аграрный университет им. И. Т. Трубилина, Краснодар, Россия
**ООО «Апиценна»
Аннотация. В статье представлены результаты исследования по изучению клинической эффективности лекарственного препарата для ветеринарного применения Габитабс при идиопатическом цистите кошек. Эксперименты были проведены в условиях ветеринарной клиники Айболит (г. Краснодар) на целевых видах животных – кошках (n=16) с диагнозом идиопатический цистит. Установлено, что лечение идиопатического цистита кошек с применением в схеме лечения ветеринарного препарата Габитабс в дозировке 10 мг/кг в течение 7-ми дней 2 раза в сутки способствовало выздоровлению животных опытной группы за 8,75±0,90 сут. против 14,12±0,81 сут. в контроле, что на 61,4 % эффективнее в пользу опытной группы. При изучении показателей общего анализа мочи отмечено достоверное снижение содержания белка у животных обеих групп к концу опыта, с преимуществом в 17,8 % в пользу животных, получавших в схеме лечения препарат Габитабс. В результатах ультразвукового исследования мочевого пузыря кошек, а также в биохимическом и гематологическом анализе крови после курса лечения идиопатического цистита между животными опытной и контрольной групп статистически достоверной и диагностически значимой разницы отмечено не было.
Ключевые слова: кошки, идиопатический цистит, FIC (ИЦК), габапентин, лекарственное средство, эффективность, УЗИ, биохимия крови, гематология крови, анализ мочи.
Одной из наиболее распространенных патологий нижнего отдела мочевыделительной системы у молодых домашних кошек является идиопатический цистит (FIC). Долгое время этиология ИЦК была неизвестной и терапевтические подходы строились на устранении кристаллурии, изменении рН мочи и применении антибактериальных препаратов. Впоследствии при более глубоком рассмотрении проблемы было замечено, что триггером для развития цистита выступает стресс. Установлено, что у кошек с FIC более крупные сенсорные нейроны в спинных рогах, и они, как правило, выделяют больше норадреналина, чем нормальные кошки. У кошек, предрасположенных к ИЦК наблюдается десенсибилизация альфа-2-рецепторов в центральной нервной системе, что приводит к меньшему ингибированию норадреналина и выбросу гормонов стресса в организм. Такие кошки находятся в постоянном гипервозбудимом состоянии борьбы, бегства или замирания. У кошек с FIC наблюдается патология, связанная с нарушением слоя глюкозаминогликанов уротелия, который защищает его от воздействия токсических продуктов мочи. Нарушение в слое глюкозамингликанов связано с высвобождением вещества Р, одного из основных нейротрансмиттеров, опосредующих боль, тревогу и стресс. Новое понимание механизма развития FIC у кошек открыло широкие возможности для успешной коррекции состояния через блокирование тревожности и стрессовой реакции.
Нами была проведена клиническая апробация препарата на основе габапентина в терапии кошек с идиопатическим циститом. Габапентин широко применятся в гуманной медицине как антиконвульсант в купировании нейропатической боли у пациентов. Однако, в настоящее время он уже зарекомендовал себя в ветеринарной медицине как препарат для устранения повышенной тревожности у собак и кошек [1-4].
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Исследование эффективности препарата на основе габапентина (далее – Габитабс) при идиопатическом цистите кошек провели с февраля по май 2022 г в ветеринарной клинике Айболит, г. Краснодар.
По принципу парных аналогов было сформировано 2 группы домашних кошек (контрольная и опытная) по 8 в каждой, средним весом 4,26±0,25 кг в возрасте от 1 г. 2 мес. до 11 лет с симптомами цистита [2, 7]. При первичном обращении у животных собирали анамнез, общий анализ мочи, проводили ультразвуковую диагностику мочевого пузыря, биохимические и морфологические анализы крови [5-7]. Повторно животных исследовали при выздоровлении.
Ультразвуковое исследование мочевого пузыря осуществляли на аппарате Mindray BC-2800Vet, интерпретацию полученных данных согласовывали с литературными источниками [8-10].
Сбор мочи для общего анализа проводили с помощью цистоцентеза, анализ проводили при помощи визуальных тест-полосок для анализа мочи «Уриполиан -11А» (Биосенсор АН, Россия), плотность определяли на Рефрактометре RZ-128 (RZ, Китай), также проводили микроскопию осадка и цитологическое исследование мочи.
Для морфологических исследований цельной крови использовали пробирки вакуумные объемом 2,0 мл, с реагентом ЭДТА-K2 (МиниМед, Россия). Для биохимических исследований сыворотки крови использовали пробирки вакуумные объемом 2,0 мл, с реагентом (клот-активатор SiO2) (МиниМед, Россия).
Морфологические исследования крови проводились на автоматическом гематологическом анализаторе Mindray DC-T6, а также использовались стандартные гематологические исследования, принятые в ветеринарной диагностической практике.
Биохимические исследования показателей крови проводили на экспресс-анализаторе MNCHIP V2 (Tianjin MNCHIP Technologies Co., Ltd, Китай) с набором дисков для биохимического экспресс-анализатора Pointcare (Tianjin MNCHIP Technologies Co., Ltd, Китай). Полученные данные по гематологическим исследованиям сравнивали со значниями до начала терапии животных и с референсными показатели для вида [11-13].
Все животные, участвующие в опыте, содержались в квартирных условиях без выгула. Кормление было 2-х разовым, в основе рациона - промышленные сухие корма премиум-класса, вода у всех животных находилась в постоянном свободном доступе.
Схемы лечения для опытной и контрольной группы представлены в таблице 1.
Таблица 1
Схема лечения идиопатического цистита кошек
|
Группа |
Назначение |
|
Опытная |
Габитабс 10 мг/кг, 2 р/день, 7 дней КотЭрвин, перорально, 2 мл 2 р/день, 7 дней |
|
Контрольная |
КотЭрвин, перорально, 2 мл 2 р/день, 7 дней СтопСтресс ½ – ¼ табл., 2 раза в день, 14 дней |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
На основании данных клинического осмотра, результатов анализа крови и мочи было установлено, что применение препарата Габитабс в схеме лечения идиопатического цистита кошек является более эффективным, чем аналогичное лечение без его использования. Установлено, что сроки лечения идиопатического цистита кошек контрольной группы были выше, чем в опытной группе, получавшей габапентин (рисунок 1). Время, потребовавшееся для полного выздоровления животных опытной группы, составило 8,75±0,90 сут., в контрольной 14,12±0,81 сут. Разница между группами была статистически достоверной (р≤0,001) и составила 5,37 сут. или 61,4 %.
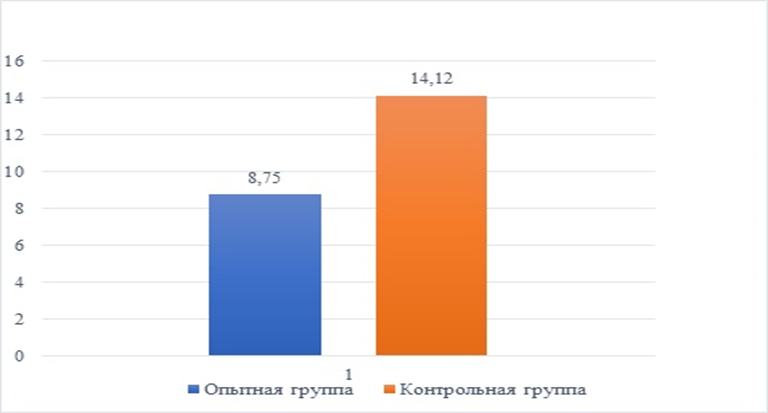
Рис. 1. Количество дней лечения ИЦК
Анализируя данные динамики живой массы тела подопытных кошек (рисунок 2) видно, что изменения живой массы тела животных в течение всего периода испытаний в разрезе групп были незначительными. При измерении данного показатели в 1-й день опыта, среднегрупповая масса тела кошек опытной группы составила 4,40±0,34 кг, в контроле 4,17±0,34 кг, при контрольном взвешивании было отмечено, что масса тела животных опытной группы увеличилась на 0,7 % и составила 4,43±0,32 кг, тогда как в контрольной группе было зафиксировано снижение на 0,1 кг (2,4 %). Данные изменения у животных контрольной группы могут быть связаны с более длительным периодом лечения, однако статистической достоверности полученных цифровых значений зафиксировано не было.
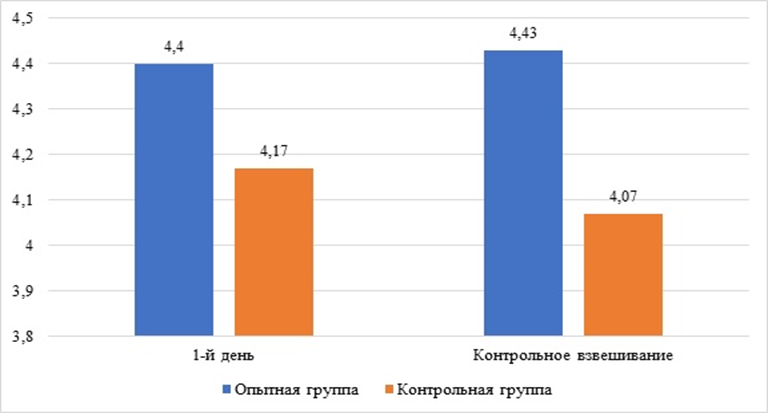
Рис. 2. Динамика средней живой массы тела подопытных кошек
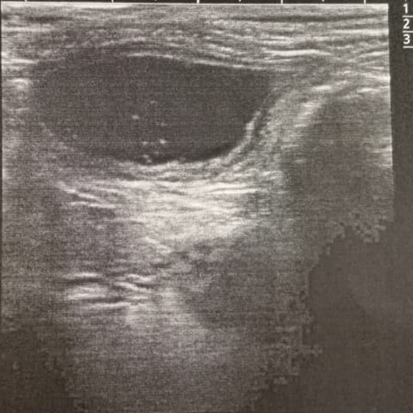
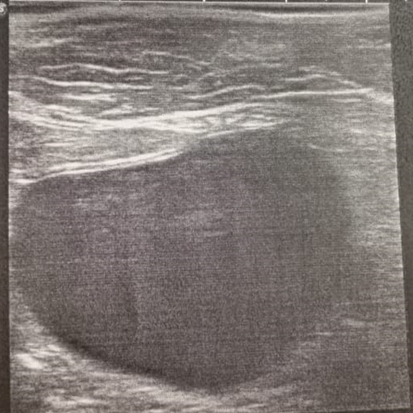
При проведении ультразвукового исследования мочевого пузыря у кошек с идиопатическим циститом, установлено, что при первичном исследовании, у животных всех групп мочевой пузырь визуализировался, топографическое положение соответствовало анатомическим нормам, отмечалось утолщение слизистого слоя, дифференциация слоёв стенки была не чёткой (рисунок 3).
|
|
|
|
Рис. 3. УЗИ мочевого пузыря при ИЦК |
|
Анализ толщины стенки мочевого пузыря представлена на рисунке 4.
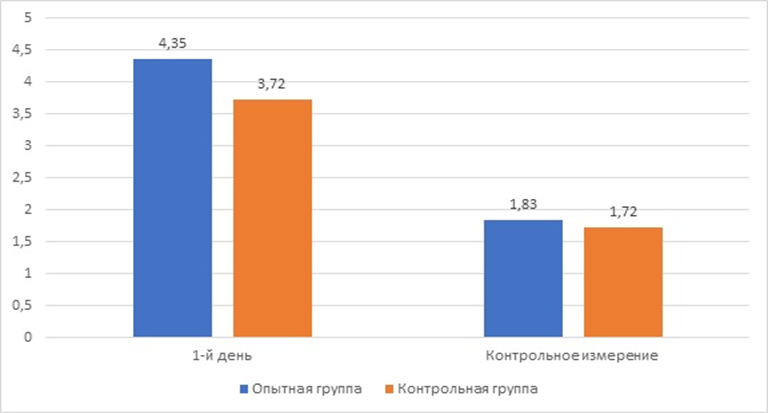
Рис. 4. Толщина стенки мочевого пузыря кошек при идиопатическом цистите и после лечения
При проведении ультразвукового исследования мочевого пузыря животных установили, что толщина стенки мочевого пузыря у кошек опытной группы в день обращения в клинику составила 4,35±0,34 мм, в контрольной группе - 3,72±0,24 мм (при норме от 1 до 2,3 мм в зависимости от наполненности мочевого пузыря). Увеличение толщины стенки мочевого пузыря свидетельствует о развитии воспалительного процесса.
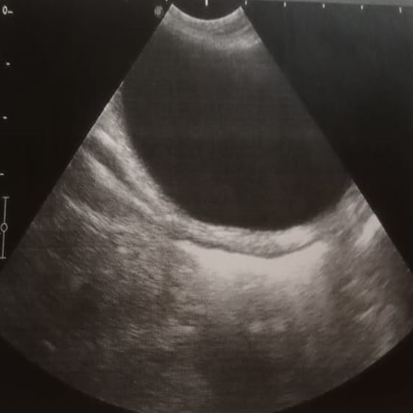
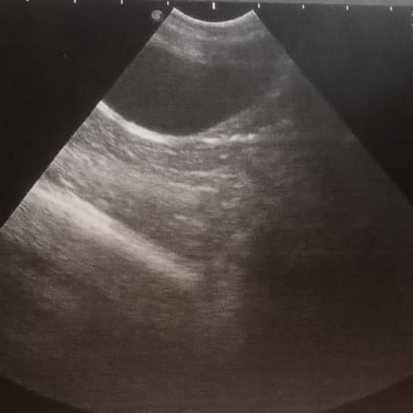
При проведении повторного измерения мочевого пузыря у кошек (рисунок 5) установлено, что во всех группах мочевой пузырь хорошо визуализируется, был разной степени наполненности, эхогенность стенки не была повышена, дифференциация слоев четкая, слизистый слой не утолщён, содержимое однородное, эхогенное, не содержит осадка. Толщина стенки мочевого пузыря у животных опытной группы уменьшилась на 57,9 %, составив 1,83±0,13 мм, у кошек контрольной группы изменения составили 53,7 % (1,72±0,09 мм).
|
|
|
|
Рис 5. УЗИ мочевого пузыря после лечения ИЦК |
|
Результаты общего анализа мочи подопытных кошек при первичном исследовании также демонстрировали изменения, характерные для цистита. Уровень лейкоцитов у животных опытной группы составил 5,75±2,11 ед/п.з., в контрольной группе 2,62±1,45 ед/п.з., уровень белка составил в опытной группе 20,00±5,08 г/л, в контрольной группе 13,12±3,39 г/л, рН у животных опытной группы находилось в пределах физиологической нормы и составила 5,46±0,83 ед, в контрольной группе - превышал референсное значение, составив 7,31±0,16 ед. Количество эритроцитов в моче животных опытной группы составило 106,25±35,50 ед/в п.з., в контрольной 36,87±24,18 ед/в п.з. При микроскопии осадка у животных обеих групп обнаружен плоский эпителий, эритроциты, единичные лейкоциты. При цитологическом исследовании мочи выявлен плоский эпителий и единичные лейкоциты (табл. 2)
Таблица 2
Результаты общего анализа мочи кошек с FIC
|
Показатель |
1-е измерение |
Контрольное измерение |
Норма |
||
|
Опытная |
Контрольная |
Опытная |
Контрольная |
||
|
Лейкоциты, ед/п.з. |
5,75±2,11 |
2,62±1,45 |
1,50±0,50 |
1,00±0,56 |
0,0–3,0 |
|
Кетоны, ммоль/л |
0,25±0,25 |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
0,0 |
|
Уробилиноген |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
0,0 |
|
Билирубин |
0,62±0,62 |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
0,0 |
|
Белок, г/л |
20,00±5,08 |
13,12±3,39 |
0,25±0,25** |
2,50±1,33** |
0,0–0,2 |
|
Глюкоза, ммоль/л |
2,50±2,50 |
0,00±0,00 |
0,00±0,00 |
0,00±0,00 |
0,0 |
|
Удельный вес, г/мл |
1,018±0,005 |
1,014±0,002 |
1,021±0,004 |
1,017±0,001 |
1,020- 1,025 |
|
Эритроциты, ед/п.з. |
106,25±35,50 |
36,87±24,18 |
5,62±3,19 |
8,12±6,11 |
0,0 |
|
pH, ед |
5,46±0,83 |
7,31±0,16 |
5,68±0,81 |
6,37±0,12** |
5,0–6,5 |
* P ≤ 0,001 – по сравнению с животными контрольной группы
При повторном исследовании мочи леченных кошек, было установлено, что количество лейкоцитов у кошек опытной группы снизилось до 1,50±0,50 ед/в п.з. и в контрольной группе до 1,00±0,56 ед/в п.з. Отмечено снижение белка в опытной группе на 98,75 % и в контроле на 80,95 %. Эритроциты в моче животных испытуемых групп после курса лечения еще превышали значения нормы, однако снижение данного показателя составило 94,71 % в опытной группе и на 77,98 % в контроле. Результаты микроскопии осадка и цитологии не выявили отклонений от референсных показателей животных.
Морфологические показатели крови подопытных кошек находились в пределах физиологических норм (таблица 3). Однако, стоит отметить некоторые изменения: количество лейкоцитов у кошек опытной группы до лечения составило 12,31±1,73 тыс/мкл, а после лечения 10,65±0,64 тыс/мкл – снижение составило 13,48 %, в контрольной группе данный показатель снизился лишь на 9,46 %. Было отмечено статистически достоверное снижение количества эритроцитов у животных опытной группы к концу опыта на 25,76 %, в контроле снижение данного показателя составило 6,94 %, однако данное изменение не являлось статистически достоверным. Уровень эозинофилов в опытной группе в начале опыта составил 1,75±0,36 %, к концу опыта данный показатель снизился на 7,43 %, в контрольной группе отметили противоположную ситуацию: к концу эксперимента эозинофилы увеличились на 33,69 %.
Таблица 3
Результаты общего анализа крови подопытных кошек
|
Показатель |
1-е измерение |
Контрольное измерение |
Норма |
||
|
Опытная |
Контрольная |
Опытная |
Контрольная |
||
|
Лейкоциты, тыс/мкл |
12,31±1,73 |
13,22±1,34 |
10,65±0,64 |
11,97±0,78 |
5,5–18,5 |
|
Эритроциты, млн/мкл |
7,57±0,68 |
7,92±0,25 |
5,62±0,43* |
7,37±0,19 |
5,3–10,0 |
|
Тромбоциты, тыс/мкл |
433,25±32,89 |
497,25±18,34 |
422,62±15,50 |
471,50±14,49 |
300,0–630,0 |
|
Гематокрит, % |
36,87±2,46 |
36,25±1,89 |
39,00±0,70 |
40,12±1,74 |
26,0–48,0 |
|
Гемоглобин, г/л |
117,25±8,26 |
111,25±6,17 |
127,00±3,25 |
124,12±5,53 |
80,0–150,0 |
|
Сред. Объем эритроцитов, мкм3 |
47,37±1,33 |
46,87±1,38 |
49,37±0,62 |
47,75±1,13 |
43,0–53,0 |
|
Сред. Концентр. гемоглобина в эритроците, % |
32,87±0,58 |
36,25±1,93 |
32,87±0,44 |
37,75±0,99 |
31,0–36,0 |
|
Сред. Содержание гемоглобина в эритроците, пг |
15,75±0,55 |
16,87±0,58 |
15,37±0,46 |
15,25±0,25* |
14,0–19,0 |
|
Лимфоциты, % |
42,50±2,44 |
31,00±2,48 |
42,75±1,13 |
36,25±1,81 |
36,0–51,0 |
|
Сегментоядерные нейтрофилы, % |
58,25±5,62 |
51,87±6,65 |
56,62±3,53 |
55,12±3,22 |
35,0–75,0 |
|
Палочкоядерные нейтрофилы, % |
2,75±0,36 |
1,50±0,56 |
2,12±0,35 |
1,75±0,25 |
0,0–3,0 |
|
Эозинофилы, % |
1,75±0,36 |
1,87±0,81 |
1,62±0,32 |
2,50±0,46 |
0,0–4,0 |
* P ≤ 0,05 – по сравнению с животными контрольной группы
Таблица 4
Результаты биохимического анализа сыворотки подопытных кошек
|
Показатель |
1-е измерение |
Контрольное измерение |
Норма |
||
|
Опытная |
Контрольная |
Опытная |
Контрольная |
||
|
АЛТ, Ед/л |
35,75±2,52 |
35,25±3,663 |
34,87±1,46 |
41,25±2,47 |
8,0–60,0 |
|
АСТ, Ед/л |
40,32±2,91 |
33,37±2,46 |
41,00±1,68 |
42,75±2,40* |
12,0–45,0 |
|
ЩФ, Ед/л |
91,75±6,86 |
93,62±8,39 |
90,50±3,44 |
105,37±4,86 |
49,0–90,0 |
|
Мочевина, ммоль/л |
9,81±2,34 |
7,26±1,21 |
6,92±0,14 |
4,92±0,20 |
5,4–12,1 |
|
Глюкоза, ммоль/л |
4,86±0,21 |
4,87±0,29 |
4,70±0,19 |
7,41±0,24 |
3,3–6,3 |
|
Креатинин, мкмоль/л |
142,37±47,58 |
108,62±18,44 |
105,75±7,26 |
102,87±5,33 |
70,0–165,0 |
|
Общий белок, г/л |
73,37±2,69 |
64,50±1,21 |
68,37±0,75 |
66,12±1,21 |
54,0–79,0 |
|
Общий билирубин, мкмоль/л |
8,02±0,53 |
7,41±0,42 |
7,47±0,42 |
7,66±0,24 |
2,0–12,0 |
* P ≤ 0,01 – по сравнению с животными контрольной группы
Биохимические показатели крови, представленные на таблице 4, взятые у подопытных кошек, соответствовали физиологической нормы для данного вида и возрастной группы животных. Однако, имелись незначительные различия. Так, уровень АЛТ у кошек опытной группы до лечения составил 35,75±2,52 Ед/л, к концу опыта данный показатель незначительно снизился и составил 34,87±1,46 Ед/л, в контрольной группе уровень АЛТ к концу опыта увеличился на 17,02 %. Также было отмечено достоверное увеличение АСТ в контрольной группе: в начале опыта его уровень составил 33,37±2,46 Ед/л, к концу опыта 42,75±2,40 Ед/л, изменение составило 28,11 %, в опытной группе к концу опыта отметили незначительное увеличение данного показателя на 1,69 %. Было отмечено значительное снижение уровня мочевины к концу опыта у животных опытной и контрольной групп на 29,46 % и 32,23 % соответственно.
ЗАКЛЮЧЕНИЕ
По результатам исследований применение препарата Габитабс, разработанного ООО «Апиценна» (Россия) для мелких домашних животных в схеме лечения идиопатического цистита кошек было эффективным. Назначение габапентина способствовало ускорению выздоровления животных на 61,4 %, в сравнении с кошками, не получавшими препарат. Таким образом, Габитабс может быть рекомендован в клинической практике ветеринарного врача в протоколе лечения идиопатического цистита кошек
СПИСОК ИСТОЧНИКОВ
1. Sarah J. Wooten, Feline interstitial cystitis: Its not about the bladder. https://www.dvm360.com/view/feline-interstitial-cystitis-it-s-not-about-bladder. November 30, 2017
2. Forrester S. D. Feline idiopathic cystitis / S. D. Forrester, T. L. Towell // Vet Clin North Am Small Anim Pract. – 2015. – P. 783-806.
3. Jones E, Palmieri C, Thompson M, Jackson K, Allavena R. Feline Idiopathic Cystitis: Pathogenesis, Histopathology and Comparative Potential / E. Jones [et al.] // J Comp Pathol. – 2021. – P. 18-29.
4. Crowell-Davis S. L., Murray T. Combinations in: veterinary psychopharmacology // S. L. Crowell-Davis, T. Murray // Ames, Iowa: Blackwell Publishing. – 2006. – P. 234-240.
5. Воронин, Е. С. Клиническая диагностика с рентгенологией / Е. С. Воронин, Г. В. Сноз, М. Ф. Васильев и др. –М.: Колос, 2006. – 509 с.
6. Правила проведения доклинического исследования лекарственного средства для ветеринарного применения, клинического исследования лекарственного препарата для ветеринарного применения, исследования биоэквивалентности лекарственного препарата для ветеринарного применения» (приказ Минсельхоза России от 06.03.2018 № 101 (ред. от 05.06.2020), зарегистрировано в Минюсте России 05.06.2018 № 51296).
7. Воронин, Е. С. Практикум по клинической диагностике с рентгенологией / Е. С. Воронин и др. – М. ИНФРА – М, 2014. – 355 с.
8. Зуева Н. М. УЗИ в ветеринарии. Мелкие домашние животные. Органы брюшной полости / Н. М. Зуева, В. А. Сургина // М. : Видар, 2015. – 192 c.
9. Mannion P. Diagnostic Ultrasound in Small Animal Practice 1st Edition / P. Mannion // Blackwell Publishing, 2006. – 344 p.
10. Делорм С. Руководство по ультразвуковой диагностике. 3-е изд. Пер. с англ. / С. Делорм, Ю. Дебю, К.-В. Йендерка // М. : МЕДпресс-информ. – 2021. – 408 с.
11. Кондрахин И. П. Методы ветеринарной клинической лабораторной диагностики. − М. : «Колосс». − 2004. − 520 с.
12. Медведева М. А. Клиническая ветеринарная лабораторная диагностика. – М.: «Аквариум Принт». – 2013. – 416 с.
13. Мейер Д. Ветеринарная лабораторная медицина. Интерпретация и диагностика. Пер. с англ. / Д. Мейер, Дж. Харви // М.: Софион. – 2007. – 456 с.
ИНФОРМАЦИЯ ОБ АВТОРАХ
Н. О. Костянко – аспирант;
А. Х. Шантыз – доктор ветеринарных наук, профессор кафедры биотехнологии, биохимии и биофизики;
И. С. Жолобова – доктор ветеринарных наук, профессор кафедры биотехнологии, биохимии и биофизики;
Ю. А. Лысенко – доктор биологических наук, профессор кафедры биотехнологии, биохимии и биофизики;
Е. Ю. Марченко – кандидат ветеринарных наук, ветеринарный врач;
О. В. Петрова – кандидат ветеринарных наук, специалист по фармаконадзору
GABITABS – A NEW APPROACH TO THE TREATMENT OF IDIOPATHIC CYSTITIS IN CATS
Kostyanko Nikolai Olegovich*, Shantyz Azamat Khazretovich*, Zholobova Inna Sergeevna*, Lysenko Yury Andreevich*, Marchenko Evgeny Yurievich*, Petrova Olga Vladislavovna**
*Kuban State Agrarian University named after I. T. Trubilin, Krasnodar, Russia
**«Apicenna» limited liability company, Moscow, Russia
N. O. Kostyanko – post-graduate student;
A. Kh. Shantyz – Doctor of Veterinary Sciences, Professor of the Department of Biotechnology, Biochemistry and Biophysics;
I. S. Zholobova – Doctor of Veterinary Sciences, Professor of the Department of Biotechnology, Biochemistry and Biophysics;
Yu. A. Lysenko – Doctor of Biological Sciences, Professor of the Department of Biotechnology, Biochemistry and Biophysics;
E. Yu. Marchenko – Candidate of Veterinary Sciences, veterinarian;
O. V. Petrova – Сandidate of Veterinary Sciences, Pharmacovigilance specialist.
Annotation. The article presents the results of a study on the clinical efficacy of the drug for veterinary use Gabitabs in feline idiopathic cystitis. The experiments were carried out in the conditions of the «Aibolit» veterinary clinic (Krasnodar) on the target animal species – cats (n=16) with a diagnosis of idiopathic cystitis. It was established that the treatment of idiopathic cystitis in cats with the use of the veterinary drug Gabitabs in the treatment regimen at a dosage of 10 mg/kg for 7 days 2 times a day contributed to the recovery of the animals of the experimental group in 8,75±0,90 days vs 14,12±0,81 days in control, which is 61,4 % more effective in favor of the experimental group. When studying the parameters of the general analysis of urine, a significant decrease in the protein content in animals of both groups by the end of the experiment was noted, with an advantage of 17,8 % in favor of the animals that received Gabitabs in the treatment regimen. In the results of ultrasound examination of the bladder of cats, as well as in the biochemical and hematological analysis of blood after the course of treatment of idiopathic cystitis, there was no statistically significant and diagnostically significant difference between the animals of the experimental and control groups.
Keywords: cats, idiopathic cystitis, FIC, gabapentin, drug, efficacy, ultrasound, blood biochemistry, blood hematology, urinalysis.
REFERENCES
1. Sarah J. Wooten, Feline interstitial cystitis: Its not about the bladder. https://www.dvm360.com/view/feline-interstitial-cystitis-it-s-not-about-bladder. November 30, 2017.
2. Forrester S. D. Feline idiopathic cystitis / S. D. Forrester, T. L. Towell // Vet Clin North Am Small Anim Pract. – 2015. – P. 783-806.
3. Jones E, Palmieri C, Thompson M, Jackson K, Allavena R. Feline Idiopathic Cystitis: Pathogenesis, Histopathology and Comparative Potential / E. Jones [et al.] // J Comp Pathol. – 2021. – P. 18-29.
4. Crowell-Davis S. L., Murray T. Combinations in: veterinary psychopharmacology // S. L. Crowell-Davis, T. Murray // Ames, Iowa: Blackwell Publishing. – 2006. – P. 234-240.
5. Rules for conducting a preclinical trial of a medicinal product for veterinary use, a clinical trial of a medicinal product for veterinary use, a study of the bioequivalence of a medicinal product for veterinary use” (Order of the Ministry of Agriculture of Russia dated 06.03.2018 No. 101 (as amended on 05.06.2020), registered with the Ministry of Justice of Russia on 05.06 .2018 No. 51296).
6. Voronin E. S. Klinicheskaya diagnostika s rentgenologiej / E. S. Voronin, G. V. Snoz, M. F. Vasil'ev [et al.] // M.: Kolos, 2006. – 509 p.
7. Voronin E. S. Praktikum po klinicheskoj diagnostike s rentgenologiej / E. S. Voronin [et al.] // M. INFRA – 2014. – 355 p.
8. Zueva N. M. Ultrasound in veterinary medicine. Small pets. Abdominal organs / N. M. Zueva, V. A. Surgina // M. : Vidar, 2015. – 192 p.
9. Mannion P. Diagnostic Ultrasound in Small Animal Practice 1st Edition / P. Mannion // Blackwell Publishing, 2006. – 344 p.
10. Delorme S. Guide to ultrasound diagnostics. 3rd ed., Translated from English / S. Delo, Yu. Debyu, K.-V. Yenderka // Moscow : MEDpress-inform. – 2021. – 408 p.
11. Kondrakhin I. P. Methods of veterinary clinical laboratory diagnostics. − M. : "Colossus". − 2004. − 520 p.
12. Medvedeva M. A. Clinical veterinary laboratory diagnostics. – M.: "Aquarium Print". - 2013. – 416 p.
13. Meyer D. Veterinary laboratory medicine. Interpretation and diagnostics. Translated from English / D. Meyer, J. Harvey // M.: Sofion. - 2007. – 456 p.